Kuramsal olarak tüm tepkimeler 2 yönlüdür. Ancak bazı tepkimelerde geri tepkime çok yavaş olduğundan bu tür tepkimeler tek yönlü sayılır.
Çift yönlü tepkimelerde denge söz konusudur. Kapalı bir kapta, tepkimeye giren maddelerle ürünlerin bir arada olduğu durumlarda bir dengeden söz edilir (dikkat, denge için kapalı sistem şarttır).
![]()
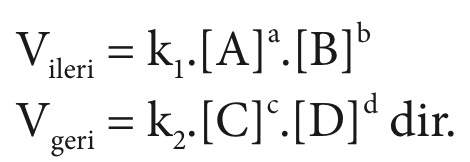
Sistem dengede ise ![]() eşitliği vardır (yani vileri = Vgeri ).
eşitliği vardır (yani vileri = Vgeri ).
Yukardaki eşitlikte her 2 tarafı ![]() ‘ye bölelim (amaç
‘ye bölelim (amaç ![]() ‘yi elde etmek).
‘yi elde etmek).
Böylece ![]() elde edilir ki
elde edilir ki ![]() ‘ye denge sabiti KD denir.
‘ye denge sabiti KD denir.
Denge sabitinin belli bir birimi yoktur, tepkimedeki katsayılara göre değer alır.
Sonuç olarak ![]() olur.
olur.
Bir mekanizmaya sahip tepkimelerde denge bağıntısı yavaş adıma göre değil toplu denkleme göre yazılır. Bir sistem dengede değilse o anda hesaplanan denge sabitine KQ denir. Matematiksel olarak düşünürsek;
KD>KQ ise KD=KQ olması için denge bağıntısındaki pay büyüyüp, payda küçülmelidir. Pay ürünlerden oluştuğuna göre tepkime ürünlerin artması yönünde olmalıdır.
Yani tepkime sağa doğru yürür. KD<KQ ise yukarda anlatılanların tam tersi gerçekleşir. Denge bağıntısında gazların molar derişimi yerine, kısmi basınçları alınırsa;
![]() eşitliği elde edilir (bir gaz karışımında gazların kısmi basınçları, molar derişimleri ile doğru orantılı olduğuna göre yukardaki eşitlik kolayca bulunabilir). KD ile KP arasında; KP= KD.(R.T).n bağıntısı vardır. ∆n, gaz halindeki ürünlerin katsayıları ile girenlerin katsayıları toplamı farkıdır. ∆n= 0 ise KD =KP olur.
eşitliği elde edilir (bir gaz karışımında gazların kısmi basınçları, molar derişimleri ile doğru orantılı olduğuna göre yukardaki eşitlik kolayca bulunabilir). KD ile KP arasında; KP= KD.(R.T).n bağıntısı vardır. ∆n, gaz halindeki ürünlerin katsayıları ile girenlerin katsayıları toplamı farkıdır. ∆n= 0 ise KD =KP olur.
Sıvıların ve katıların derişimleri sabit olduğundan denge denkleminde yer almazlar.
Hangi tepkimelerde dengenin söz konusu olduğunu anlamak için, minumum enerji ve maksimum düzensizliğe bakılır. Eğer her ikisi de aynı yönde ise denge söz konusu olamaz.
![]()
tepkimesini ele alalım.Tepkime ekzotermik olduğundan ürünlerin enerjisi daha azdır. Ürünler 7 mol, girenler 6 mol olduğuna göre maksimum düzensizlik ürünler lehinedir. Hem minimum enerji, hem de maksimum düzensizlik ürnler lehine olduğuna göre bu tepkimede denge söz konusu olamaz.
![]()
durumunda ise H2O(s)‘nın enerjisi daha azdır. H2O(g) ise gaz halinde olduğundan maksimum düzensizliğe sahiptir. Minimum enerji sol taraf, maksimum düzensizlik sağ taraf lehine olduğundan denge vardır.
Bir tepkimede giren maddelerin hepsi veya herhangi biri tam olarak tükenirse bu tepkime tam verimle gerçekleşmiş olur. Denge sorularında verilen sıcaklık derecesi genellikle sorunun çözümünde kullanılmaz. İki ayrı sıcaklık derecesi verilirse, diğer verilere göre yorum yapılır.
Katı ve sıvıların derişimi sıcaklıkla değişir. Sıcaklık arttığında hacim artıyorsa molar derişim azalır (Molar derişim bölümünü okuyun). Tepkimede girenler ve ürünler aynı fazda ise buna homojen denge denir.
KD bağıntısında gazlar ve sulu çözeltiler, KP bağıntısında ise yalnız gazlar yer alır. Denge durumunu bozan dış etkiler; derişim, hacim (basınç) ve sıcaklıktır.
KD yalnız ve yalnız sıcaklıkla değişir.Sıcaklık sabit iken derişim ve hacimde değişiklikler olursa tepkime KD‘yi sabit tutmak için sağa veya sola yönelir (Le Chatelier ilkesi bölümünü okuyun). 2 tepkimenin KD‘leri verilmişse, toplu denklemin KD‘sini bulmak için KD ler çarpılır (toplu denklem için, denklemler toplanırken KD lerin çarpılmasına dikkat!).
Denklem ters çevrilirse, KD de ters çevrilir.
Allotrop cisimlerde amorf olanlar, kristal yapıda olanlara göre daha düzensizdir. Bu nedenle grafit elmasa göre daha düzensizdir.
Ürünler tarafında sabit derişimli maddeler varsa KD yazılrken pay’a 1 yazılır.
![]() şeklinde yazılır.
şeklinde yazılır.
![]() tepkimesinde sabit sıcaklık ve basınçta ortama A(g) eklenirse denge sağa kayar.
tepkimesinde sabit sıcaklık ve basınçta ortama A(g) eklenirse denge sağa kayar. ![]() tepkimesinde sabit sıcaklık ve basınçta ortama A(k) eklenirse KD değişmez. Derişimi sabit olan maddeler, denge denkleminde yer almadıkları için bu maddelerin miktarlarının değişmesi KD‘yi değiştirmez.
tepkimesinde sabit sıcaklık ve basınçta ortama A(k) eklenirse KD değişmez. Derişimi sabit olan maddeler, denge denkleminde yer almadıkları için bu maddelerin miktarlarının değişmesi KD‘yi değiştirmez.
< Kimyasal Bağlar – Koordine Kovalent Bağ >